心血管植介入材料与器械(血管支架、心脏瓣膜、心脏封堵器、人工小血管等)植入体内后面临复杂且多样的组织应答,如凝血和炎症反应等,严重制约了器械的服役性能,早期的应答失衡也是导致器械失效的重要诱因。血管内皮层作为生物体固有的抗凝抗炎界面,能够有效维护血管周围微环境的稳态平衡,调节凝血及炎症组织反应。实现植入器械表面完整健康的内皮细胞层再生,是心血管植介入材料表面的理想状态,也是当前科学家们追逐的研究方向和技术难点。然而,以内皮化为目的的改性手段往往忽视了再内皮化前的组织反应对内皮化进程带来的不良影响,材料表面的功能修饰往往也因植入前期的凝血与炎症应答紊乱面临失效的风险。

近期,国家生物医学材料工程技术研究中心王云兵教授团队,围绕心血管植介入器械植入后面临的组织反应为出发点,以内皮细胞表面血栓调节蛋白的自调节抗凝功能为灵感,结合材料植入后的全过程抗炎功能需求,提出了一种辅助心血管植介入材料表面再内皮化的新思路,即一种结合抗炎功能的凝血酶敏感自调节抗凝涂层改性新策略。在材料表面没有实现正常内皮覆盖的早期阶段,这种涂层有望代替并行使部分内皮细胞的血栓调节蛋白抗凝血功能,从而抑制材料早期剧烈的凝血反应,同时配合全过程的抗炎保护,为后续的器械表面再内皮化进程提供良好微环境保障。相关成果发表在国际知名综合性期刊Science Advances上(2022, 8, 9, eabm3378),国家生物医学材料工程技术研究中心/生物医学工程学院2019级博士研究生王雅楠为该论文第一作者,国家生物医学材料工程技术研究中心主任/生物医学工程学院院长王云兵教授、以及国家生物医学材料工程技术研究中心副研究员罗日方为该论文共同通讯作者。该论文工作同时还得到了德国莱布尼茨聚合物研究所Manfred F. Maitz博士的相关帮助。国家生物医学材料工程技术研究中心为该论文的唯一通讯单位。
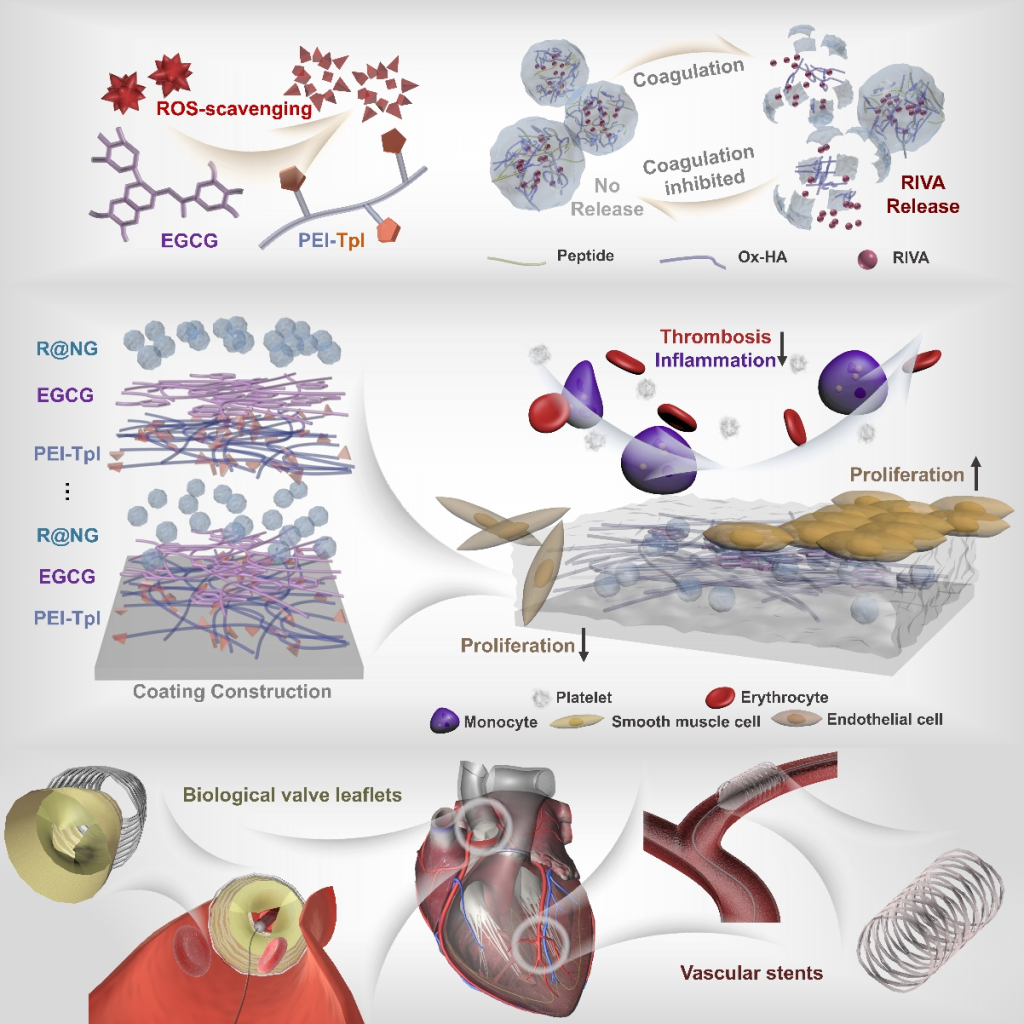
图1. 结合抗炎与凝血酶敏感的自调节抗凝策略的制备过程示意图
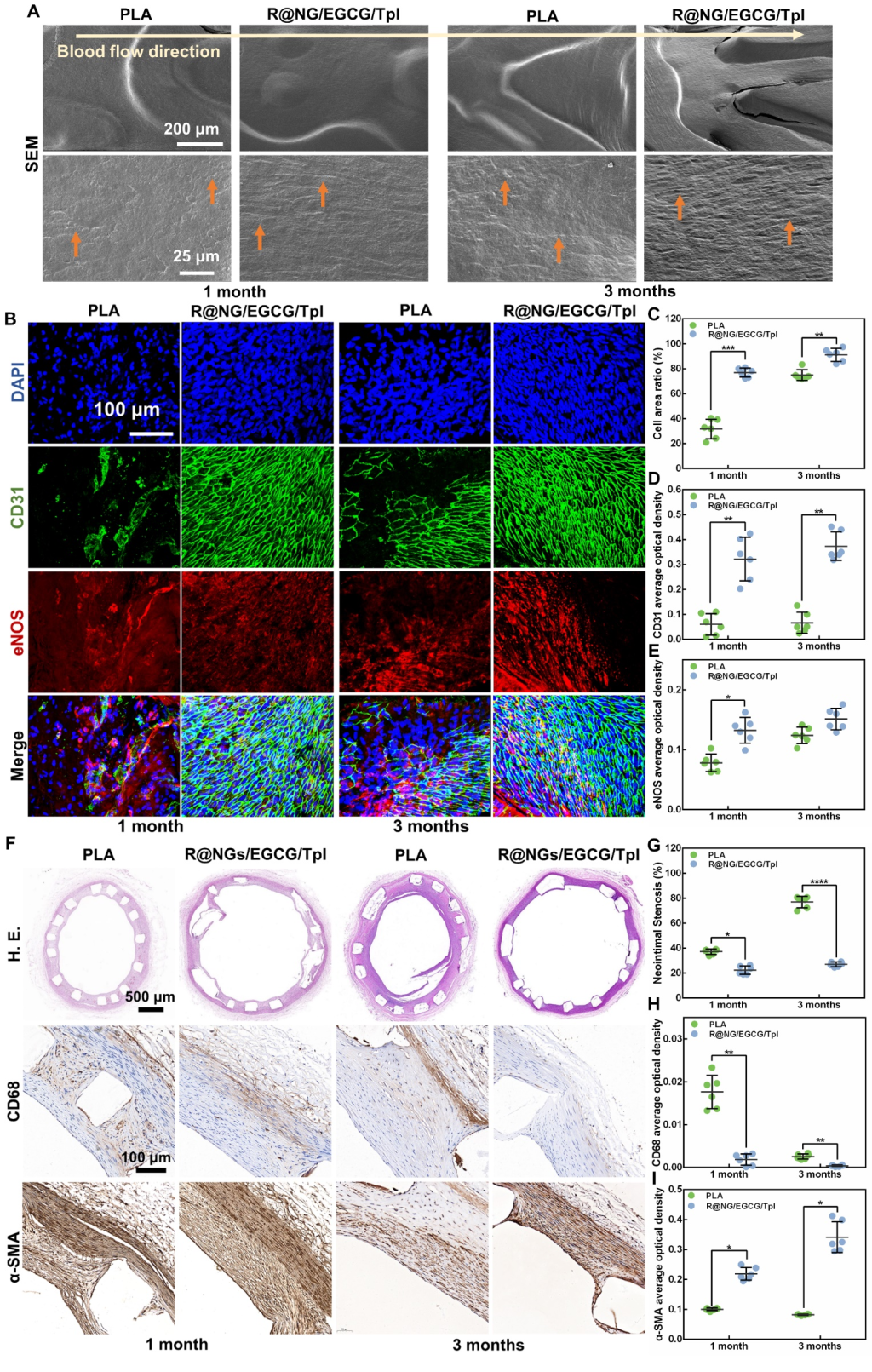
图2. 改性涂层提高血管支架的血液相容性、宿主反应、再内皮化和抗增生能力
该涂层的抗凝功能由封装凝血酶抑制剂的凝血酶敏感纳米凝胶实现,纳米凝胶能够在环境凝血酶的刺激下释放抗凝药物,进而阻断凝血级联反应。超氧化物歧化酶模拟物Tempol与多酚类物质表没食子儿茶素没食子(EGCG)扮演协同抗氧化的角色,能够抵御自由基与炎症反应,克服单一抗氧化剂抗炎有限的劣势。本研究中,上述功能模块被巧妙的封装并制备成涂层,用于保护心血管材料,使用了两种典型的心血管植介入材料作为模型,即生物瓣膜和血管支架,验证了该涂层的有效性和多功能性(图1)。研究结果也表明,通过干预内皮化进程前期的组织反应来实现对后续内皮化的保护思路呈现了可行性和较大的潜力(图2)。本研究中的,依靠凝血酶响应来实现自调节精确抗凝血和炎症保护的新型功能涂层改性策略,能够抑制由于凝血和炎症反应引起的不良后果,为心血管植介入材料表面的再内皮化提供保驾护航的良好微环境,有望为材料学家设计仿生内皮的功能涂层提供新视角。
王云兵教授团队长期致力于心血管疾病治疗的新型生物医用材料和医疗器械的应用基础研究与产品开发,立足于心血管医疗器械的临床需求,以新型生物材料研发为基础,结合血流动力学研究力学仿真模拟及机械设计,优化相关产品的关键参数,与企业及医院合作,进行大规模动物实验及临床试验验证,形成材料研发-力学设计-产品开发-临床验证全链条研发机制,最终实现相关心血管医疗器械的大规模产业化应用。已申报国内外专利近500项,国际期刊发表论文200余篇。
论文链接:https://www.science.org/doi/10.1126/sciadv.abm3378
文章来源:https://www.scu.edu.cn/info/1207/21523.htm